Содержание
Типы химических элементов
В природе можно найти самые разные вещества. Эти вещества обычно не встречаются в чистом виде, а являются результатом комбинации различных элементов или материалов, которые в результате различных реакций, процессов и периодов времени дали начало всем видам материи. Во Вселенной нет ничего, что не являлось бы результатом комбинации атомов, принадлежащих к разным типам химических элементов, которые мы собираемся изучить более подробно.
Однако, прежде чем рассматривать типы химических элементов, давайте сделаем небольшой обзор школьной науки и вспомним, что такое химические элементы.
Мы называем «химическим элементом» материю, которая состоит из одного и того же типа атома, то есть вещества, которое является атомарно чистым. Химические элементы не могут быть разложены на более простые и классифицируются в периодической таблице элементов как чистые материалы Вселенной.
Мы не должны путать элементы с простыми веществами, поскольку в некоторых случаях два или более атомов одного и того же элемента могут составлять молекулы, сгруппированные по-разному, что приводит к изменению некоторых физических свойств рассматриваемого элемента, в этих случаях изотопов. Например, алмаз и углерод — это вещества, состоящие из химического элемента углерода (C), но который организован по-разному и приводит к образованию двух совершенно разных материалов.
Насколько нам известно, химические элементы образуются внутри звезд в результате сложных процессов синтеза и деления атомов, в результате которых образуются все более тяжелые элементы, результат процесса, называемого нуклеосинтезом.
Большинство известных элементов могут быть получены из природы, спонтанно обнаружены или образуют соединения с другими элементами, такими как уран (U), углерод (C), кремний (Si), серебро (Ag) или золото (Au). Другие, однако, производятся в лабораториях, например, америций (Am), берклий (Bk) или кюрий (Cm). Каким бы ни был метод его получения или присутствует ли он в природе, в зависимости от его свойств, рассматриваемый химический элемент будет иметь то или иное применение.
В настоящее время известно около 118 химических элементов, хотя с учетом того, что люди смогли производить новые элементы, расширение таблицы Менделеева — это вопрос времени.
Основные типы химических элементов
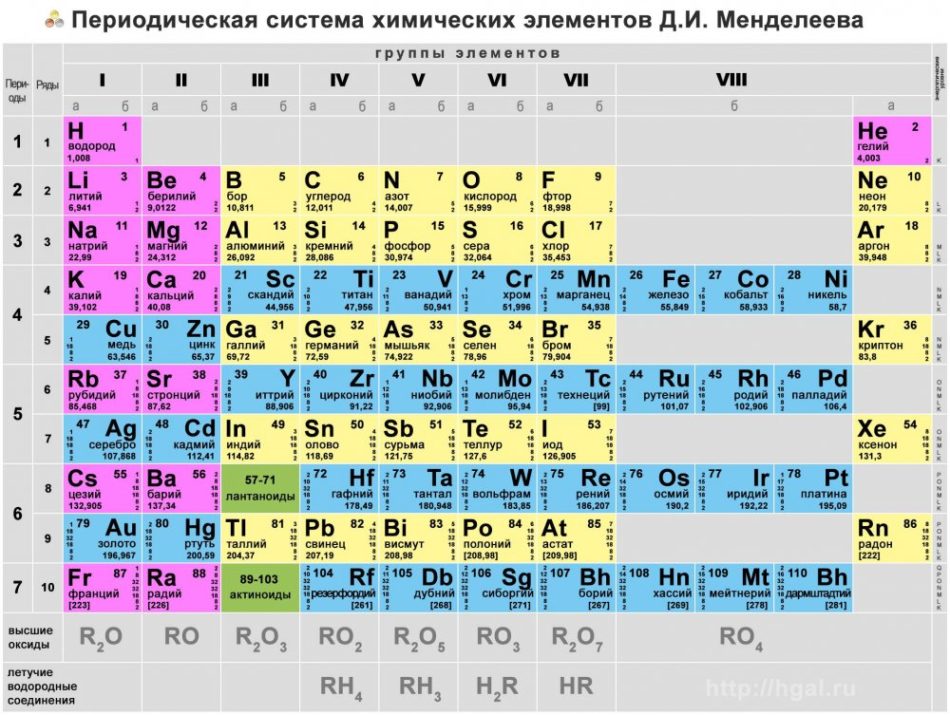
Основные типы химических элементов представлены в периодической таблице, системе классификации, созданной русским химиком Дмитрием Менделеевым (1834–1907), заложившим ее основы в 1869 году. Химические элементы визуально упорядочены в зависимости от их свойств и характеристик.
С течением времени и по мере того, как химия сделала важные научные открытия, эта таблица будет последовательно расширяться, достигнув той формы, которую она имеет сегодня, с 118 известными до сих пор элементами.
В настоящее время в этой таблице мы можем найти следующие типы химических элементов:
Металлы
Металлы — это химические элементы, которые, как правило, содержат от одного до трех электронов на последней орбите своего атома, электроны, которые можно легко переносить, превращая их в проводники тепла и электричества.
Металлы обычно податливы и пластичны, с характерным блеском, интенсивность которого зависит от движения электронов, составляющих их атомы. В большинстве случаев металлы остаются твердыми при комнатной температуре, за исключением ртути.
Среди металлов мы находим золото (Au), серебро (Ag), медь (Cu) и алюминий (Al), физические характеристики которых делают их великолепными проводниками электричества, хотя их присутствие в природе очень разнообразно, что отражается в разнице между их массами.
Считается, что 75% химических элементов, существующих в природе — это металлы, а остальные 25% будут состоять из благородных газов, металлоидов и других типов.
В этой категории есть классификации, обнаруживающие актиниды, лантаноиды, переходные металлы, щелочные металлы, щелочноземельные металлы и другие металлы.
Лантаноиды
Элементы лантаноидов находятся в месторождениях, состоящих из многих минералов. Это металлы белого цвета, которые легко окисляются при контакте с воздухом. Среди них мы находим лантан (La), прометий (Pm), европий (Eu) и иттербий (Yb).
Актиниды
Все изотопы актинидов радиоактивны. Среди них мы находим актиний (Ac), уран (U), плутоний (Pu) и эйнштейний (Es).
Переходные металлы
Переходные металлы расположены в центральной части периодической системы. Их основная характеристика состоит в том, что они имеют электронную конфигурацию «d» -орбитали, частично заполненную электронами.
В этой группе есть вещества всех видов, и, согласно ее самой широкой классификации, она будет соответствовать химическим элементам от 21 до 30, от 39 до 48, от 71 до 80 и от 103 до 112, всего сорок и среди них мы найдем ванадий (V), рутений (Ru), серебро (Ag), тантал (Ta) и лоуренсий (Lr).
Щелочные металлы
Щелочные металлы — это группа из шести элементов, состоящая из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Это блестящие мягкие металлы, обладающие высокой реакционной способностью при нормальной температуре и давлении и легко теряющие внешний электрон, расположенный на своей «s» орбитали.
Щелочные почвы
Щелочноземельные металлы — это группа элементов, в которых мы находим бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Щелочные почвы тверже щелочей, они блестят и являются хорошими проводниками электричества. Они менее реактивны, чем щелочные, и действуют как хорошие восстановители. Они обладают способностью образовывать ионные соединения, и все они имеют два электрона на внешней оболочке.
Другие металлы
Это металлические элементы, расположенные в периодической таблице вместе с металлоидами внутри p-блока. Они имеют тенденцию быть мягкими с низкими температурами плавления. Среди них алюминий (Al), индий (In), олово (Sn) и висмут (Bi) среди других.
Не металлы
Неметаллы обычно имеют от пяти до семи электронов на последней орбите, свойство, которое заставляет их приобретать электроны, а не отдавать их, и, таким образом, им удается иметь восемь электронов, которые таким образом стабилизируют их как атомы.
Эти элементы очень плохо проводят тепло и электричество. К тому же они не имеют характерного блеска, не очень пластичны и очень хрупки в твердом состоянии. Их нельзя катать или растягивать, в отличие от металлов.
Большинство из них необходимы для биологических систем, поскольку они присутствуют в органических соединениях, таких как сера (S), углерод (C), кислород (O), водород (H) и йод (I).
Металлоиды
Металлоиды представляют собой промежуточную классификацию между металлами и неметаллами, обладающими свойствами обеих групп. Это связано с тем, что на последней орбите у них четыре атома, что является промежуточным количеством по сравнению с металлами и неметаллами.
Эти химические элементы проводят электричество только в одном направлении, но не в обратном, как в металлах. Примером этого является кремний (Si), металлоид, используемый в производстве полупроводниковых элементов для электронной промышленности благодаря этому свойству.
Другие металлоиды: бор (B), мышьяк (As), сурьма (Sb) и полоний (Po).
Галогены
Галогены — это группа из шести элементов, которые имеют тенденцию образовывать молекулы, состоящие из двух (двухатомных) атомов, которые очень химически активны из-за своей электроотрицательности.
Эти вещества обычно появляются в виде ионов, то есть электрически заряженных молекул, которые в данном случае являются однозначными, сильно окисляющими. Это означает, что галогены являются едкими веществами.
Галогены: фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и тенезе (Ts).
Благородные газы
Благородные газы — это группа из семи газов, естественное состояние которых — газообразное. Обычно они представляют собой двухатомные молекулы с очень низкой реакционной способностью, то есть они не вступают в реакцию с другими элементами, составляющими другие вещества, и по этой же причине они известны как инертные газы. Это потому, что на его последней орбите находится максимальное количество электронов, возможное для этого уровня, всего восемь.
Эта избранная группа элементов состоит из гелия (He), неона (Ne), аргона (Ar), криптона (Kr), ксенона (Xe), радона (Rn) и оганесона (Og), ранее известного как унунокций.