Мир биохимии человека во всех его смыслах объясняет метаболические процессы, происходящие внутри нас. Помимо эфирных представлений и собственной идентичности, мы должны признать, что человек — это не что иное, как набор химических путей, электрических импульсов, клеточного дыхания и полипептидных цепей, по крайней мере, на чисто физиологическом уровне.
Таким образом, тысячи маленьких молекул объясняют наше поведение, привычки и болезни. Желудочные ферменты отвечают за пищеварение в желудке, гемоглобин красных кровяных телец обеспечивает передачу кислорода нашим тканям, а высвобождение синаптических комплексов между нейронами позволяет нам думать. Проще говоря: мы — биомолекулы, которые мы синтезируем, какими бы маленькими или незначительными они ни казались.
Среди всего биологического конгломерата, которым является человеческое тело, есть ряд белков или конъюгатов, отвечающих за очень специфические функции, которые, как правило, ускользают от общего внимания.
Что такое миоглобин?
Миоглобин — это гетеропротеин, то есть он состоит из белковой части (апопротеин, аминокислоты, связанные пептидными связями) и меньшей небелковой части, простетической группы. Ключевой отличительной особенностью общего белка (холопротеина) и гетеропротеина является то, что последний содержит липиды, углеводы, нуклеиновые кислоты и даже металлы в своей трехмерной структуре.
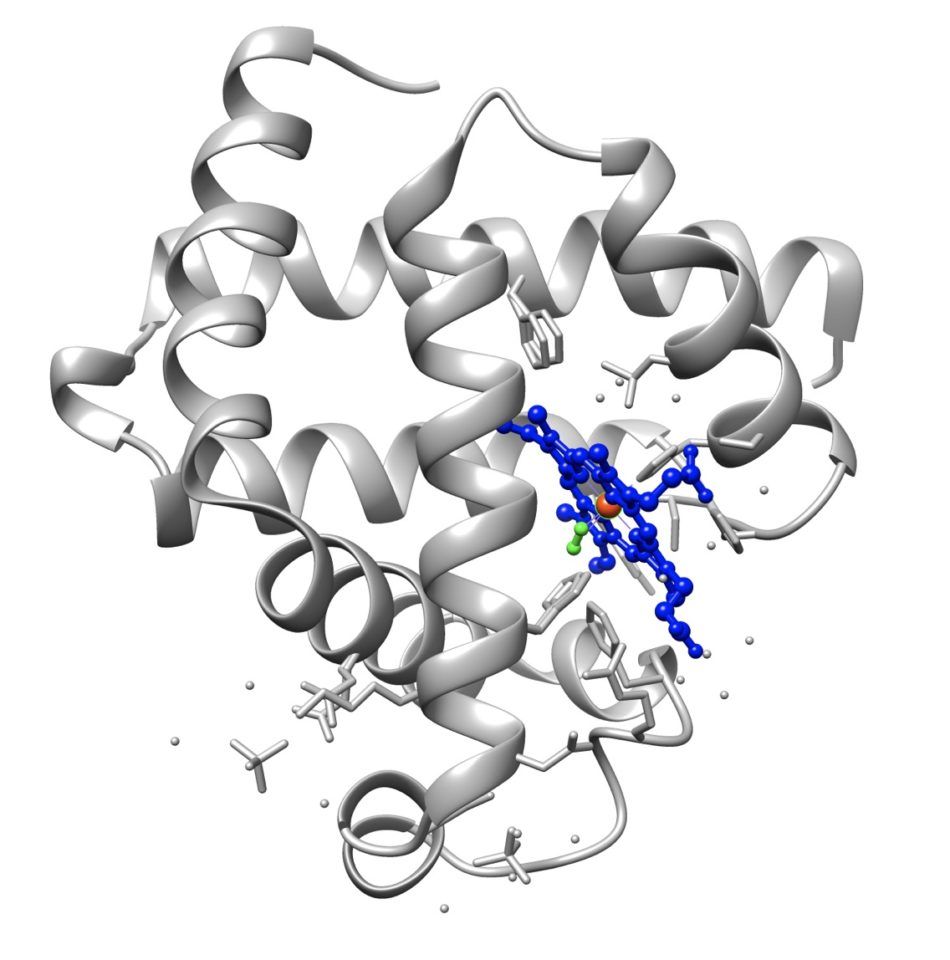
Мы можем выделить, что миоглобин является гетеропротеином хромопротеинового типа, поскольку в его химическом составе есть металл, который придает ему характерное окрашивание. Миоглобин состоит из участка полипептида из 153 аминокислот и гема, содержащего атом железа, как и гемоглобин. Благодаря этой «гемовой» группе можно сказать, что основная функция миоглобина — запасать кислород.
Кроме того, следует отметить, что миоглобин состоит из одной полипептидной цепи, состоящей из 8 альфа-спиралей (вторичная структура конформации аминокислоты), которая связана с точкой вставки кислорода. В центре у него есть порфириновое кольцо, содержащее железо. Проксимальная гистидиновая группа (His-93) напрямую связана с молекулой железа, а дистальная гистидиновая группа (His-64) расположена на противоположной стороне образования.
Напротив, гемоглобин (ответственный за транспортировку кислорода в крови внутри эритроцитов) состоит из четырех различных полипептидов и четырех точек связывания кислорода, что обеспечивает различные кинетические свойства связывания. Можно сказать, что с химической точки зрения он более «сложный», чем миоглобин.
Миоглобин состоит только из цепочки аминокислот (полипептида), которая, в свою очередь, представлена в виде 8 связанных альфа-спиралей, расположенных по спирали при трехмерном формовании. В центре гетеропротеина находится гемовая группа с молекулой железа. Если бы мы могли развернуть его третичную структуру, мы бы увидели цепочку из 8 субъединиц, прикрепленную к гемовому кольцу.
Функция миоглобина
Как и гемоглобин, миоглобин представляет собой цитоплазматический гетеропротеин, который позволяет кислороду связываться с гемовой группой. В любом случае, имея четыре полипептидных цепи (глобин), гемоглобин имеет четыре гемовые группы, что позволяет ему присоединять больше кислорода к своей третичной структуре. Таким образом, у гемоглобина больше «кислородного заряда», а у миоглобина больше сродство к нему, но в меньшем количестве (только одна гемовая группа / одна молекула O2). Эти различия связаны с функциональностью каждой молекулы: транспортирует гемоглобин, а запасает миоглобин.
Здесь следует отметить, что концентрация миоглобина наиболее высока в поперечно-полосатых мышцах позвоночных, в частности, в цитоплазме кардиомиоцитов и в саркоплазме мышечных волокон. Основываясь на этой предпосылке, можно предположить, что основная функция миоглобина заключается в обеспечении кислородом митохондрий мышц, когда организм находится в состоянии стресса, чтобы избежать гипоксии на тканевом уровне.
Другими словами, миоглобин служит буфером для внутриклеточной концентрации кислорода, а также резервом O2 на уровне мышц. Эта концепция подтверждается реальностью, столь же любопытной, как и ожидалось: животные, которые живут в воде и проводят длительные периоды времени под водой, имеют в своей клеточной среде в 30 раз больше миоглобина по сравнению с теми, у которых кислород доступен в любое время.
Вот еще несколько функций миоглобина, контекстуализированных в окружающей среде организма:
- Облегчает диффузию кислорода: этот гетеропротеин обесцвечивается в начале мышечной активности, увеличивая градиент диффузии кислорода от капилляров к цитоплазме.
- Он выполняет ферментативные функции: он необходим для активного разложения оксида азота до нитрата. Метаболизм оксида азота поддерживает митохондриальную активность.
- Помогает устранить активные формы кислорода (АФК): АФК — это очень маленькие молекулы, полученные в результате нормального клеточного метаболизма, но они могут повредить клетку и вызвать ее старение. Таким образом, миоглобин помогает свести его концентрацию к минимуму.
Как видите, функциональность миоглобина заключается не только в хранении молекулы O2 благодаря ее гемовой группе. Хотя это его основная задача, он также представляет другие, не менее важные для благополучия в клеточной среде.
Роль миоглобина в клинической картине
Миоглобин кодируется геном MB у человека и, как и все упорядоченные последовательности ДНК, подвержен мутациям. Дисфункция гена MB была связана с различными состояниями, такими как синдром компартмента или медуллобластома.
Более того, экспериментальные модели с мутированным миоглобином развивают летальные заболевания на уровне сердца во время внутриутробного развития плода. Немногочисленные модели, которые выживают в этих условиях, выражают компенсаторные механизмы, но выживаемость низкая. Поэтому утверждается, что миоглобин необходим для функционирования организма.
Помимо предположений, миоглобин напрямую связан с широко известным клиническим проявлением: рабдомиолизом. В этом серьезном состоянии происходит повреждение мембраны миоцита (мышечной клетки), что приводит к аномальному накоплению кальция в мышцах. Это приводит к лизису и некрозу мышц, что, в свою очередь, увеличивает концентрацию в крови молекул, которых там не должно быть.
Интересно, что миоглобин — это белок, который больше всего повреждает почки, когда проникает в систему кровообращения и в конечном итоге «фильтруется» в почках. Считается, что этот гетеропротеин может осаждаться в канальцах почек, накапливаться и вызывать непроходимость. Этот механизм токсичности частично объясняет, почему почечная недостаточность является одним из основных побочных эффектов рабдомиолиза.
Наконец, следует отметить, что присутствие миоглобина в моче измеряется для выявления этого состояния, поскольку концентрация 100 мг / дл способна изменить цвет мочи.
Когда мы обращаем внимание на белок, фермент или молекулу, связанные с метаболизмом, оставаться только с их основной структурой и функцией — серьезная ошибка. Да, миоглобин накапливает кислород для предотвращения мышечной гипоксии, но он также обладает ферментативной активностью, нейтрализует активные формы кислорода, способствует диффузии O2 в клеточной среде и служит одним из диагностических критериев рабдомиолиза (либо в плазме крови, либо в моче).