Содержание
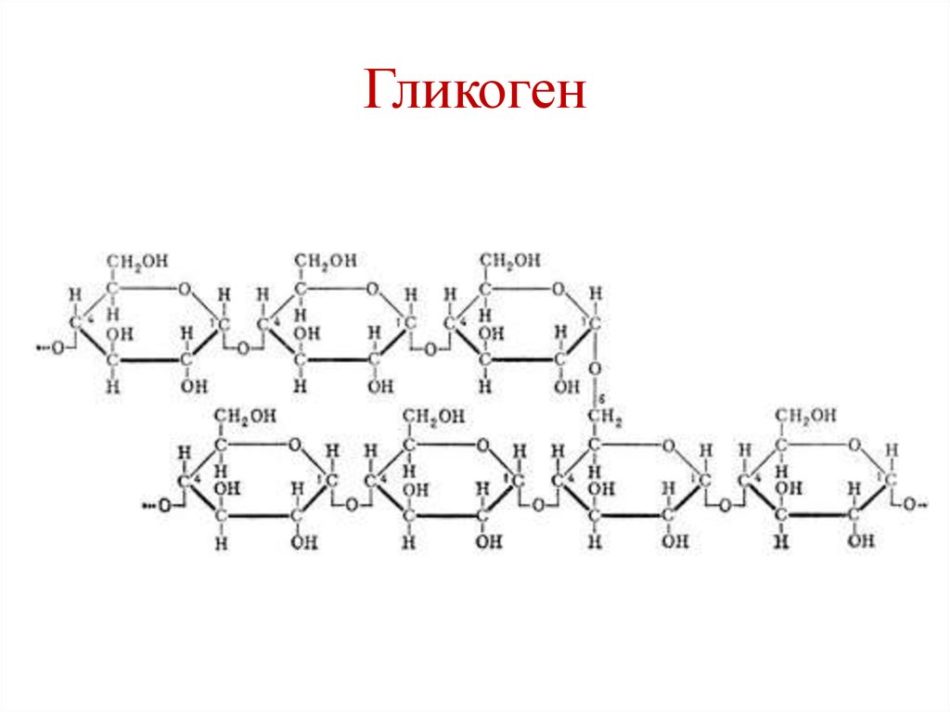
Гликоген — это полисахарид, запасенный у позвоночных и некоторых микроорганизмов, а у растений — крахмал.
Распад гликогена
Распад гликогена происходит посредством трех ферментативных реакций: гликогенфосфорилазы, фермента, разветвляющего гликоген, и фосфоглюкомутазы.
Действие гликогенфосфорилазы
Гликогенфосфорилаза удаляет остаток глюкозы в виде альфа-D-глюкозо-1-фосфата с невосстанавливающего конца. При разрыве гликозидной связи альфа-1-4 в результате атаки неорганического фосфата этот процесс повторяется до тех пор, пока он не достигнет четырех уровней глюкозы от точки разветвления. Дальнейшее разрушение происходит после действия фермента, расщепляющего ветвь.
Действие фермента, расщепляющего гликоген
Фермент разветвления катализирует две последовательные реакции переноса разветвления.
Трансферазная активность фермента разветвления — в этой реакции фермент разветвления переносит олигосахариды с разветвления на линейный.
Альфа-1-6 гликозидазная активность фермента разветвления — на этом этапе фермент разветвления разрушает альфа-1-6 гликозидную связь, освобождая одну глюкозу.
Действие фермента фосфоглюкомутазы
Он превращает освобожденный глюкозо-1-фосфат в глюкозо-6-фосфат, который может вступать в гликолиз.
Биосинтез гликогена
Биосинтез гликогена каким-то образом происходит во всех клетках тела животного, но в основном происходит в печени и скелетных мышцах. Как и гликолиз, он также начинается с глюкозо-6-фосфата, конденсированного в гликоген под действием четырех ферментов, таких как фосфоглюкомутаза, UDP-глюкозопирофосфорилаза, гликогенсинтаза, амило (1-4) в (1-6) трансгликозилазу.
Действие фосфоглюкомутазы
Здесь глюкозо-6-фосфат превращается в глюкозо-1-фосфат под действием фосфоглюкомутазы.
Действие UDP-глюкозопирофосфорилазы
Теперь глюкозо-1-фосфат превращается в UDP-глюкозу с использованием UTP и высвобождением PPi. UDP-глюкоза, сахар-нуклеотид отдает глюкозу для синтеза гликогена. Эта реакция необратима, что делает синтетический путь необратимым.
Действие гликоген-синтазы
Он катализирует перенос остатка глюкозы от UDP-глюкозы к невосстанавливающему концу гликогена, этот фермент может синтезировать гликоген без праймера, здесь предыдущие молекулы гликогена действуют как праймер, а фермент переносит глюкозу на невосстанавливающий конец гликогена праймера, увеличивая 1 остаток глюкозы в каждом цикле. Когда нет доступных гликогенов, гликогенин (белок) действует как праймер. Гликогенсинтаза не может синтезировать (1-6) связь, обнаруженную в точке разветвления, поэтому здесь нужен другой фермент.
Действие амило (1-4) на (1-6) трансгликозилазы (фермент разветвления гликогена)
Катализирует перенос длинного фрагмента с 6-7 остатками глюкозы от невосстанавливающего конца к гидроксильной группе С-6 внутреннего остатка глюкозы, создавая точку ветвления с (1-6) гликозидной связью, теперь точка ветвления также действует как праймер.
Координированная регуляция синтеза и распада гликогена
Биосинтез и распад гликогена регулируются координацией. Гликогенфосфорилаза регулируется аллостерически и гормонально, а гликогенсинтаза регулируется фосфорилированием и дефосфорилированием.
Регулирование гликогенфосфорилазы
Карл и Герти Кори обнаружили, что гликогенфосфорилаза находится в двух взаимопревращаемых формах: гликогенфосфорилаза a каталитически активна и гликогенфосфорилаза b каталитически менее активна. Фосфорилаза b преимущественно обнаруживается в мышцах в состоянии покоя во время активной мышечной активности. Адреналин приводит к фосфорилированию определенного остатка серы, превращая его в более активную форму. А когда мышцы находятся в фазе покоя, фосфорилаза фосфатаза удаляет фосфат из фосфорилазы a, превращая его в менее активную форму фосфорилазы b. Процесс регулируется в ответ на глюкозу.
Регулирование гликогенсинтазы путем фосфорилирования и дефосфорилирования
Гликоген-синтаза также может существовать в активной и неактивной форме. Здесь активная форма гликогенсинтазы-а находится в нефосфорилированной форме, ее фосфорилирование киназой гликогенсинтазы 3 (GSK-3) приводит к переходу в неактивную форму гликогенсинтазы-b. Гликоген-синтазная киназа добавляет фосфорильную группу к трем серным остаткам около карбоксильного конца, она просто не фосфорилируется до тех пор, пока другая протеинкиназа казеинкиназа II не фосфорилирует гликоген по соседнему остатку, процесс называется прайминг. Фермент PP1 вызывает дефосфорилирование под действием фосфатазы, делая его активным. Здесь процесс может регулироваться в ответ на глюкозо-6-фосфат.